


|

| 产地 | 美国 |
| 品牌 | Panbio |
| 货号 | 1 |
| 用途 | Panbio登革热快速检测试剂盒是用来定性检测人血清、血浆和全血中的登革热病毒IgM和IgG抗体的方法。 |
| 包装规格 | 25T |
| 是否进口 | 是 |

产品规格:25T/盒
澳大利亚Panbio公司一直在(Dengue fever)、罗斯河热(Ross river fever)的诊断试剂产品方面保持着 的市场地位。公司的西尼罗河(West Nile encephalopalitis)诊断试剂在 获得美国FDA注册。Panbio登革产品拥有 最广的产品系列,有着 最广的应用。
预期作用:
Panbio快速检测试剂盒是用来定性检测人血清、血浆和全血中的病毒IgM和IgG抗体的方法。这方法能用来鉴别初次和二次感染。它仅能用来检测具有临床的的样本。结果是假定阳性的,必须经病毒分离、双份血清分析、免疫组织化学检测抗原或病毒核酸检测证实有病毒感染。
原理:
在处理样本时,特异性IgM和IgG抗体和包埋在横过盒膜的两条线上的抗-人IgM和IgG抗体相结合。胶态金复合物包含重组1~4型抗原被的IgM和IgG捕获而显现出粉红色的线。设定一个对照程序来指示方法操作正确。
警示
1.所有的人血产品都应该按可能有材料来处理。疾病预防控制中心和国家健康署建议可能传染的抗原应该在2级生物安全下进行处理。
2.不要用嘴吸取液体,皮肤不要和试剂或样本接触。
3.严格按照操作规程才能得到 的结果。试剂必须小心地加以保持实验的准确度和 度。
4.超出操作规程时间和温度范围做试验可能会导致无效的结果。没有在即定的时间和温度内做试验必须要重做。
5.试剂盒内的成份是经一批单位进行质量控制的。不同批号的产品不同混合使用。不要与其它制造商的产品混合。
6.小心使用,避免试剂污染。如果确实是有微生物污染或有沉淀,就不要使用。配试剂的仪器、容器或是试剂生物污染都可导致错误的实验结果。
7.不要加热失活的样本。
8.试剂盒贮存在干燥的地方。
9.不要重复使用试剂盒。
10.如果箔袋有破损,试剂盒就不要使用。
11.试验材料应该按当地的、州和/或国家法律来处理。
试剂的贮存方法和期限
1.试剂盒贮存在2~30°C,试剂要稳定必须保持恒温,直至失效。有效期参见包装袋标签。
2.不要冷冻试剂。
3.在包装袋上标示的有效期内试剂都可使用。
4.试剂超过有效期不能使用。
样本收集和准备
1. 血在室温下(20~25oC)会凝结成块,然后根据全国临床实验标准委员会(NCCLS)(收集诊断血的认可标准程序,H3-A4, 1998)进行离心。
血清应尽快分离并冷藏(2~8oC)或是冷冻(-20oC),如果在两天内不试验的话,应冷冻在更低的温度下。血清、有溶血的、脂血的或是有细菌生长的血清都不推荐使用
2. 不推荐使用自我解冻的致冷机来贮存样本,因为它能引起样本经过冻融周期和降低抗体水平,因此产生假结果。
3.指端血采集后要马上测试。NCCLS建议含有EDTA或肝素作为抗凝剂的全血可以不经离心就立即使用,或者也可以在2~8 oC放上72小时(血样处理加工的认可标准程序,H18-A2, 1999)
4.发热开始后样本的采集时间决定了试验的准确度。在发热开始后的6~14天采得的样本能得到 的结果。
试剂盒组成
每个试剂盒包括下面的东西,数量足够能完成包装袋标签上标明的测试份数。
?25小包。每包里面有一个试剂盒和一个10μL的MicroSafe®移液管。
?1份使用说明书。
?1管3ml的缓冲液(含有0.1% Proclin)
必要的但不提供的材料
?计时器
一般程序
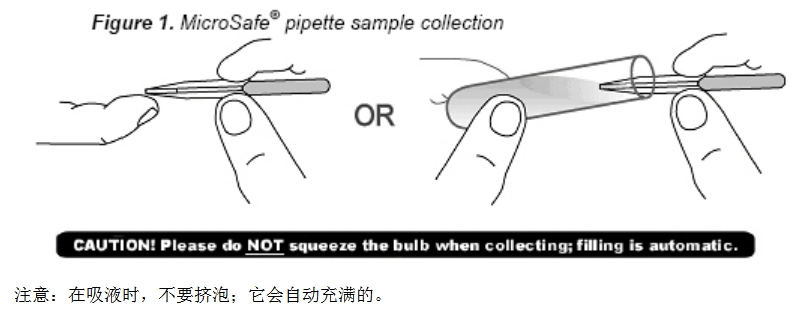
MicroSafe®移液管的操作方法
MicroSafe®移液管能用来吸全血、血浆或血清。
在吸液时请严格遵照下面的使用说明(图1):
1.水平地拿着移液管。
2.吸液时,移液管的 和测试样本接触(见下图1)。
3.轻轻地挤泡排出样本。
测试程序:
注意:在开始实验前确保所有的试剂平衡至室温(20-25°C)。
要用时,才从袋内拿出试剂盒和MicroSafe®移液管。

. 用微量移液器或是提供的MicroSafe®移液管在圆孔内加入10μL的全血、血清或血浆。
. 让样品完全吸收融入圆孔里的样品垫内。
. 在方孔上方1cm处垂直地拿着缓冲瓶。
. 在试剂盒底部的方孔内加入2滴缓冲液。
加缓冲液的刚刚15分钟后读结果。
. 在测试区域内出现粉红色线的痕迹就表明阳性结果。
. 超过15分钟后读取的结果将认为是无效的,必须要重做。
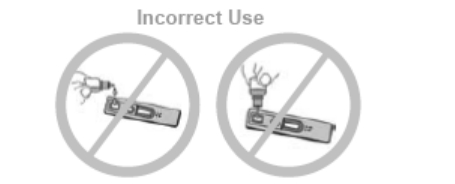
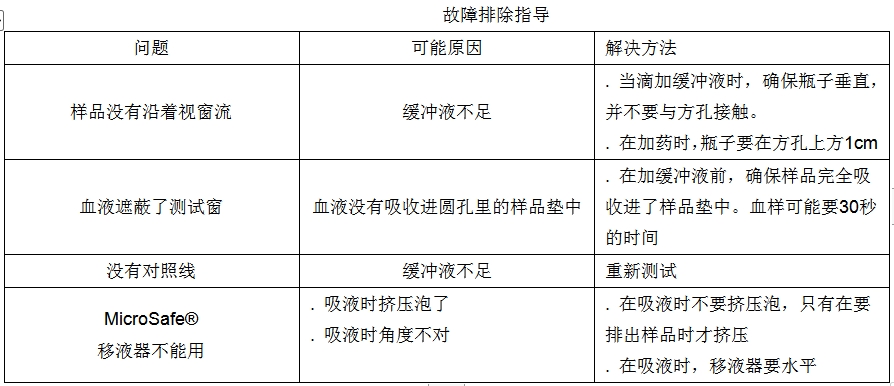
错误的使用用法
1.加液时,瓶子不能水平。
2.加液时,瓶子不能接触到样品孔
质量控制:
1.如果没有出现对照线,则测试无效得重做。如果测试无效,则结果不能报告。
2.全血样品可能会在视窗内出现红色的背景值。如果它没有遮盖住测试线则结果有效。
3. 质量控制需要必须遵照当地的、州和/或国家法律或委任书和你们实验室标准质量程序。建议用户参照NCLSI C24-A和42 CFR 493.1202(c)中的合适的质量控制实践指导
结果解释:
初次感染表现为发热后3~5天能检测到IgM抗体。二次感染表现为感染发作后的1~2天特异性IgG水平升高,还经常伴有IgM水平的升高。应该结合IgM和IgG测试线来解释结果。单独的线分析可能不够准确。
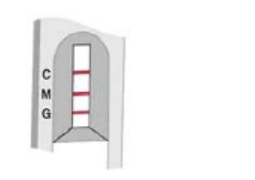
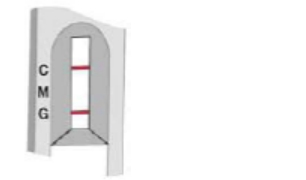
C:对照线 M:IgM测试线 G:IgG测试线

初次感染
在IgM和对照区域出现粉红色条带
测试说明IgM抗体阳性,且表明有初次感染。
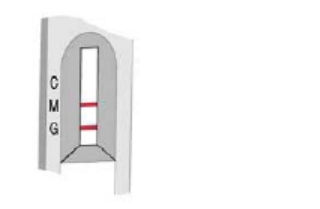
二次感染
在IgM、IgG和对照区域出现粉红色条带
测试说明IgM和IgG抗体阳性,且表明二次感染。
二次感染
在IgG和对照区域出现粉红色条带
测试说明IgG抗体阳性,且表明二次感染。
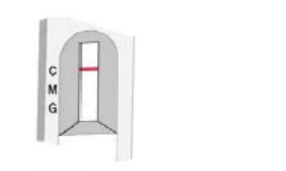
阴性
仅仅在对照区域出现粉红色条带
没有检测到IgM和IgG抗体。结果不能排除感染。如果怀疑有感染,则在3~4天后重新测试。
无效
在对照区域没有出现粉红色条带
测试无效得重做。
测试的局限性:
1.一个单独测试样本的分析不能作为诊断的 标准。
2.在早期感染和一些二次感染中, IgM抗体的可检测水平可能很低。一些在感染后的头7~10天可能不会产生可检测到水平的抗体。只要还存在,我们就建议在 份样本后的3~4天对重新进行测试。
3. 和黄病毒属出现血清学交叉反应是常见的事(即在1,2,3,4型和圣路易、西尼罗河、日本、黄热病病毒等之间)。
4.最终的诊断应建立在结合测试结果和其它临床和实验室发现的基础之上。
5. 不能用来做一般人群的筛查。阳性预值依赖于现存在病毒的可能性。只能对有临床的进行测试,或者有可疑暴露时。
6.抗体的继续存在或不存在不能用来决定 的成功与否。
7.从得来的结果解释要慎重。
8. 的测试结果来自发热后的6~14天采集的样本。
性能鉴定数据
灵敏性和特异性
为了评估Panbio Dengue Duo Cassette的灵敏性和特异性,我们用血清、血浆和全血在内部和马来群岛和斯里兰卡独立的试验地点进行了试验。
血清
回顾性地选择的样本来自于马来群岛一个试验点的临床怀疑有感染的在住院后采集的冷冻的血清。一组血清包括30对初次感染的血清、30对二次感染的血清和80份经实验室测试是感染阴性的血清,对这些进行了评估。诊断是建立在内部IgM ELISA法和血凝抑制(HAI)测试的基础之上的,HAI是用滴度≥1:2560来定义二次感染的。结果概括见表1。
血浆
Panbio公司用208份血浆样本对Panbio Duo小盒的性能进行了临床研究。经PanbioDuo IgM 和 IgG 捕获ELISA法认定,这208份样本包括93份血清阴性、32份初次感染和83份二次感染样本。结果概括见表2。
全血
斯里兰卡的一个研究所测试了331份全血和血清样本,这些样本来自于那些因符合感染体征和而送到医院的。这组包括74份血清阴性、77份初次感染和180份二次感染样本。用试剂盒内提供的MicroSafe移液管采集手指血,用Panbio Duo小盒来测试。在采集得到血清,再用PanbioDuo IgM 捕获 和 IgG 捕获 ELISA (E-DEN01D)来确定。测试结果与的血清状况进行比较以测定那方法用来测定全血样本时的灵敏性,特异性和一致性。结果概括见表3。
 .95% CI*
.95% CI*
相对血清灵敏性 = 104/108 96.3% 90.8 - 99.0%
相对血清特异性 = 76/80 95.0% 87.7 - 98.6%
相对血清一致性 = 162/188 86.2% 81.2 - 91.1%
*CI = 可信区间
95% CI*
相对血清灵敏性= 110/115 95.7% 92.9 - 98.4%
相对血清特异性= 77/93 82.8% 77.7 - 87.9%
相对血清一致性= 178/208 85.6% 80.8 - 90.4%
*CI =可信区间
95% CI*
相对血清灵敏性= 231/257 89.9% 86.2 - 93.6%
相对血清特异性= 66/74 89.2% 82.1 - 96.3%
相对血清一致性= 274/331 82.8% 78.7 - 86.8%
*CI =可信区间
交叉反应
通过测试一组208份来自其它确诊(非)的血清来测定PanbioDuo小盒的诊断特异性。还测试了一组来自没有证据表明感染的受试者的血清。结果概括参见表4。
表4 PanbioDuo小盒交叉反应性研究
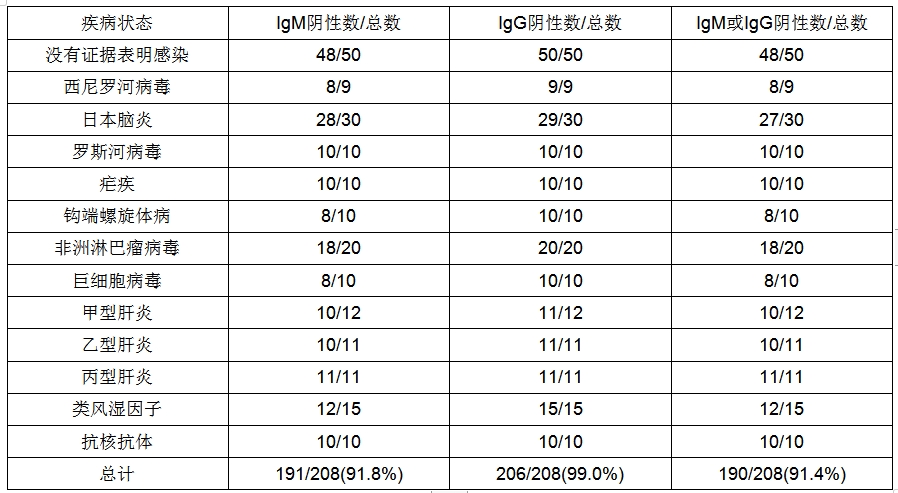
重现性
为了测定PanbioDuo小盒的重现性,我们用3个批号的试剂盒在不同的3天对9份血清进行测试。那9份血清代表了初次感染、二次感染和没有感染,然后将那测试结果和参照结果进行了比较。在15分钟时读取组内和组间测试结果,并概括见表5。
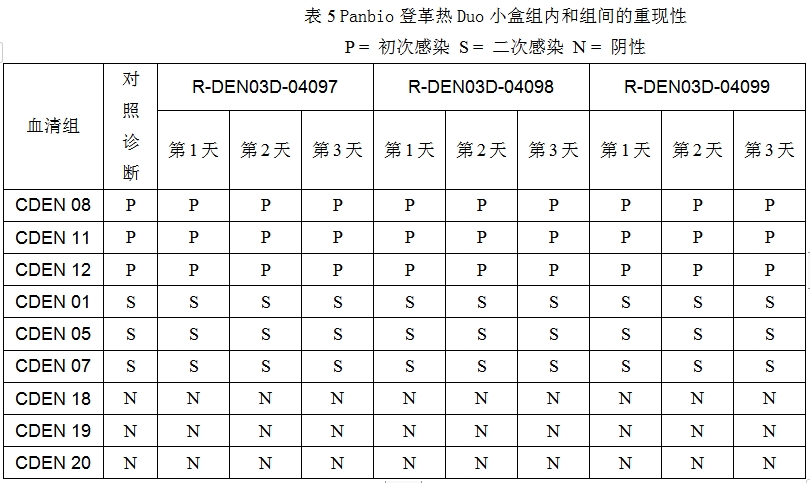
初次感染是建立在IgM阳性和IgG阴性读数基础之上的。二次感染是建立在IgG阳性和IgM阳性或阴性读数基础之上的。所有的对照线都是阳性的。
说明:健仑生物为澳大利亚Panbio公司系列产品中国地区 。此本中文版说明书是由广州健仑生物科技有限公司研究人员翻译,过程中如有错漏之处,请以厂家英文版说明书为准。谢谢!
想了解更多产品信息,欢迎咨询我们获取资料。健仑生物竭诚为您服务。